十二指肠内获取胰腺液样本的应用研究
摘要
关键词
胰腺液;样本获取;十二指肠大乳头;胰蛋白酶
正文
1. 前言
胰腺液检测在消化道临床中具有极高的价值,它不仅可以帮助医生诊断和监测急性胰腺炎、慢性胰腺炎、胰腺癌等相关疾病,同时也能为确定治疗方案和评估病情提供重要依据。在急性胰腺炎的诊断中,胰腺液中的淀粉酶和脂肪酶水平的变化具有很高的参考价值1,白细胞计数和炎症标志物水平也可以反映炎症的严重程度。在慢性胰腺炎的检测中,胰腺液中的脂肪酶和弹性蛋白酶的水平可反映腺体的受损程度2。胰腺液中的肿瘤标志物水平和基因突变分析对于早期胰腺肿瘤的发现具有重要意义3–5。这些标志物和基因突变的存在可以帮助医生确定肿瘤的遗传特征,为制定差异化个性化的治疗方案提供了依据。
然而,当前临床中主要采取的ERCP6、EUS7、PTC8等穿刺获取胰腺液的方法存在许多问题。首先,这些方法的取样时间较长,给患者带来一定的痛苦和不便。其次,这些方法对医生的操作技能要求较高,需要经验丰富的专业人员进行操作,否则可能无法达到预期的效果。最后,这些方法都属于有创检查,容易引起并发症,对于老年人和虚弱的患者来说可能难以承受。因此,开发操作难度低、无创的胰腺液检测方法具有重要的临床价值。这不仅可以减少患者的痛苦和不便,提高医疗效率,还可以降低并发症的风险,提高医疗安全性和患者的生活质量。
2. 原理
2.1. 生理原理
十二指肠是上消化道的一部分,由球部、降部、水平部、升段和空肠组成。十二指肠大乳头隐藏于十二指肠降部的褶皱中,是胆总管和胰管的共同开口处。胰腺液由胰腺内导管细胞分泌,并直接排放至胰岛管中,胰岛管与胆总管在十二指肠大乳头处汇合。在外界刺激的影响下,胰腺液开始分泌,并和胆汁混合后,从十二指肠大乳头排放至十二指肠内,因此十二指肠大乳头的排出物中,含有一定量的胰腺液成分,只要选择合适的收集条件,即可获得满足相关检测要求的胰腺液样本。
2.2. 验证原理
为了验证此方法的有效性,需要首先对排出物中胰腺液的比例进行评估。由于胰腺液的主要功能为参与食物的消化,其含有大量的消化酶,通过测定消化酶的活性来间接评估胰腺液的比例是合理且实用的方案。在胰腺液中的众多消化酶中,胰蛋白酶具有突出的特异性。胰蛋白酶主要由胰腺分泌,可专一地水解由赖氨酸和精氨酸形成的肽键,与其他消化蛋白酶相比有着显著的区别。因此,胰蛋白酶更适合作为代表性的消化酶,用于评估替代方案的可行性。
胰蛋白酶活性可采用紫外分光光度计法进行检测。检测原理为胰蛋白酶可定向分解BAEE形成BA,BA在253 nm处有特征吸收峰。通过检测单位时间吸光度的变化,可以表征胰蛋白酶的活性。取30 μL的待测液加入1 mL的比色皿中,再加入970 μL的含有BAEE的待测液中。然后迅速将比色皿放入紫外分光光度计中进行吸光度的测量。测量1分钟内样品的吸光度变化,记为ODsample。则样品的胰蛋白酶活性Activity可按照以下公式计算:
其中,ODblank为空白样品的吸光度,即待测液为纯水时的吸光度。ρ为样品的密度,通过测量样本的体积和重量获得。此处的胰蛋白酶活性定义为:在1 mL的反应体系下,37℃下每毫升样本每分钟催化253 nm的吸光度增加0.001为一个单位(U)。
3. 实验过程
3.1. 志愿者
招募20名无慢性或急性消化系统疾病,年龄在20-45之间的成年人作为志愿者,并分别编号为1至10,这里的编号仅方便表述,并不表示实验顺序或其他排名。在取样实验进行前,已对其讲解实验过程,并签署相关的知情同意书。
3.2. 样品获取
志愿者于实验前20点开始禁食,但允许喝无色的水。在取样实验过程中,患者吞下和取样附件组装后的胶囊内窥镜,并在磁控设备的引导下,将胶囊内窥镜移动至志愿者十二指肠大乳头附近,如图1所示。对志愿者播放美食视频以促进十二指肠排出物的分泌。在观察到排出物排出后,启动吸取装置,获取十二指肠大乳头排出物,至5 mL后停止吸取,将取样附件连同胶囊内窥镜一同从口腔拉出体内。所获得的样品即进行处理。
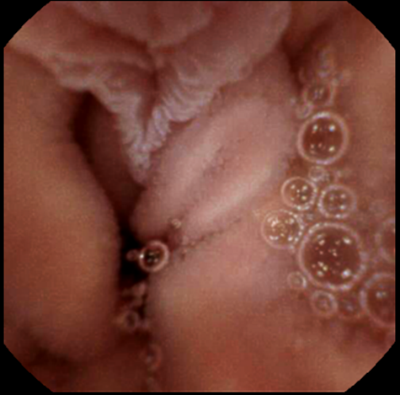
图1 胶囊内窥镜拍摄的十二指肠大乳头照片
对于志愿者4-6,除在十二指肠大乳头附近,还在十二指肠球部,十二指肠水平部分别取样,样品体积均为5 mL。
3.3. 样本处理
在室温下,将样品在4000 rpm下离5 min,分离上层清液做后续处理。取1 mL的上层清液,向其中加入100 U肠肽酶(上海源叶)和0.1 mg氯化钙(上海国药,99.9%),并用pH为8.0的Tris-HCl缓冲液稀释至5 mL,放入37恒温箱中激活一小时。
3.4. 胰蛋白酶活性检测
样品的胰蛋白酶活性采用紫外分光光度计法进行检测。试剂盒为商用的胰蛋白酶活性检测试剂盒(北京索莱宝公司),紫外分光光度计型号为HD-A830-4A(海达国际)。测量过程与原理部分相同,同一样品进行两次测量,并取平均值,记为ODsample。根据原理部分提供的公式计算样品的实际胰蛋白酶活性。
4. 数据分析
4.1. 胰蛋白酶活性最佳测量条件
在验证过程中,首先对适合测量胰蛋白酶活性的样本稀释比例进行了研究。向志愿者1-3的未激活样本添加Tris-HCl缓冲液中以进行稀释,并将原样本和不同稀释比例的样本放入反应体系中,测定一分钟内253 nm处的吸光度变化,并计算样品的胰蛋白酶活性。图2为吸光测量结果和活性计算结果,从左图中可以看到,不同稀释比例的样本的吸光度变化情况与稀释比例呈较好的线性关系。这一结论在右图中也得到了验证,在右图中,同一样本在不同稀释比例下测定的活性处于同一水平。这表明,在1:1(即未经稀释)到1:20的稀释比例内,样品中的胰蛋白酶均可充分参与BAEE的水解,而不会出现蛋白聚集影响反应效率的现象。
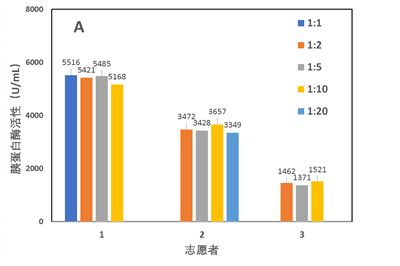
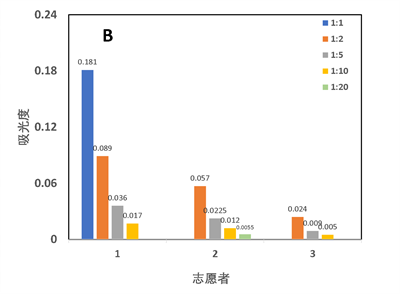
图2 同一志愿者样本不同稀释比例下测量结果
尽管较大范围的稀释比例均可满足充分参与反应的条件,但合适的稀释比例应尽量减少测量的误差。吸光度的测量误差主要来源于两方面,度数时的误差及背底吸光度的影响。度数时的误差可通过计算每秒的平均吸光度变化进行衡量,而背底的吸光度通常为0.001,可通过计算其与测量值之间的比例来衡量。表1为上述样品的秒平均吸光度变化和背底吸光度的比例。从表1可看出,对于1:1和1:2两种稀释比例,秒平均吸光度变化超过了0.001,表明对整体结果的影响较大。而对于1:10和1:20的稀释比例,背底吸光度对于结果的影响又较大。因此可认为,1:5的稀释比例是更加适合胰蛋白酶活性的比例。
表1 样品的秒平均吸光度变化和背底吸光度的比例
志愿者 | 1 | 2 | 3 | ||||||||
稀释比例 | 1:1 | 1:2 | 1:5 | 1:10 | 1:2 | 1:5 | 1:10 | 1:20 | 1:2 | 1:5 | 1:10 |
秒平均吸光度/0.001 | 3.01 | 1.48 | 0.60 | 0.28 | 0.95 | 0.38 | 0.2 | 0.09 | 0.40 | 0.15 | 0.08 |
背底吸光度比例/% | 0.55 | 1.12 | 2.78 | 5.88 | 1.75 | 4.44 | 8.33 | 18.18 | 4.17 | 11.11 | 20.00 |
其次,对肠肽酶激活过程对于样品中胰蛋白酶活性的影响进行评估。在人体内,胰腺分泌的胰蛋白酶原经肠道内肠肽酶的激活转化为胰蛋白酶,而胰蛋白酶也可自激活胰蛋白酶原。对于传统的侵入式取样方法,由于取样时间长,酶原已充分激活为胰蛋白酶,而对于本文所使用的方法,由于取样时间短,难以保证酶原被充分激活。因此,为了更准确评价此样本获取方法能否替代侵入式方法,需要对体外激活过程的效果进行验证。图3是三名志愿者的样本在未激活和已激活状态下,胰蛋白酶活性测量结果,测量均采用1:5的稀释比例,下不赘述。从结果中可以看到,激活后的样本的胰蛋白酶活性高于未激活样本至少40%,。这表明此激活过程可以满足对于样本的激活需求。
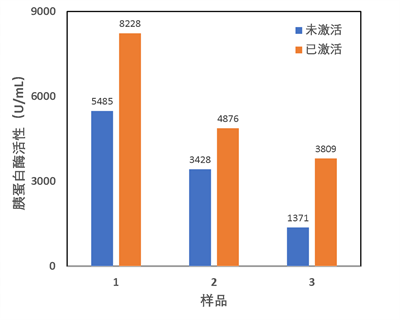
图3 同一志愿者样本未激活与已激活样品测量结果
为了验证十二指肠大乳头附近为获取排出物样本的最佳位置,对于志愿者4-6,除十二指肠大乳头外,还在其十二指肠球部和水平部取样。图4为三名志愿者不同位置的样本的胰蛋白酶活性测量结果。从图中可以看出,十二指肠大乳头附近的样本的胰蛋白酶活性约为球部样本的两倍,而水平部样本的活性不超过球部样本的60%,这表明大乳头附近的位置是最佳的取样位置。从人体结构上看,当志愿者右侧卧取样时,十二指肠大乳头所在的降部处于低点,而大乳头处于朝上的位置,此时从大乳头排出的排出物会在降部内堆积。而十二指肠球部与降部相连,且处于相近的高度,因此部分溢出的排出物会进入降部。而十二指肠水平部离大乳头的位置较远,且在右侧卧下呈上升的趋势,排出物需要经肠道蠕动才能进入水平部,因此样本内的胰蛋白酶活性最低。
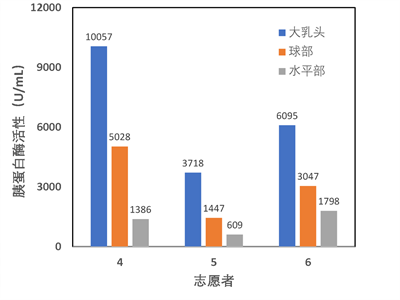
图4 同一志愿者不同位置样品测量结果
4.2. 排出物中胰蛋白酶活性范围
所有志愿者在十二指肠大乳头位置获得的样本,并测量其胰蛋白酶活性,结果如图5所示。20个样本的活性分布范围在3718-10057之间,根据样本的平均数和标准差,可计算在一定可信度下,总体的分布范围。样本胰蛋白酶活性的平均数为6381,方差为1877,在可信度为90%的情况下,k值为1.76539,据此,总体胰蛋白酶活性上下限分别为:
即,使用此方法获得的排出物样本的胰蛋白酶活性范围为3067-9695(U/mL)。
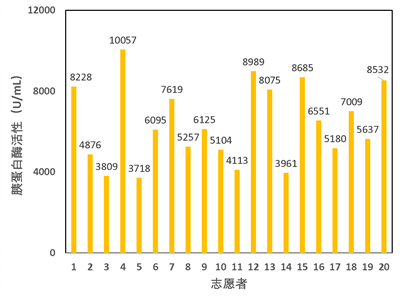
图5 不同志愿者样本的胰蛋白酶活性测量结果
4.3. 排出物中胰腺液含量
为了对比排出物样本和传统穿刺方法获取的样品,还需要获取传统方法样品中胰蛋白酶活性的数据。已发表文献中,胰蛋白酶活性的方法有多种,如放射免疫分析10,酶学分析10,分解BAPNA11,分解BAEE等方法。为了保持测量条件一直,需要选择分解BAEE方法的数据进行对比。在Bramwell等的研究中12,他们在持续收集胰腺液120分钟,并每三十分钟分离一次样品,共获得四组样品。他们使用滴定NaOH溶液测定胰蛋白酶分解BAEE后氢离子浓度的变化,并以此表征胰蛋白酶的活性。胰蛋白酶活性的测量结果为11-20 μEq./min/mL。根据Wiggins13和Sacks14等人的研究, NaOH滴定法表征胰蛋白酶活性和吸光度变化表征胰蛋白酶活性存在线性的对应关系,公式如下:
则胰液中胰蛋白酶活性的范围为7572-14799 U/mL,平均值为11107 U/mL。
比较检测十二指肠大乳头排出物中胰蛋白酶活性和文献的测量值,可以发现本文所使用方法的活性值为文献值的40%-65%之间,这表明两者处于相同的水平,且差异小于因为个体差异导致的样品胰蛋白酶活性的变化。这表明,十二指肠排出物中的胰腺液含量与传统方法获取的样品中胰腺液含量处于相同的水平,即此获取胰腺液样本的方法对传统胰腺液样本的获取方法具有一定的替代性。
5. 结论与建议
综上所述,本文首先在生理结构上论证了使用十二指肠排出物作为胰腺液样本的可行性。之后,本文通过测量样本中的胰蛋白酶活性,对样本中的胰腺液含量进行评估。测试结果表明,在合适的取样和测量条件下,通过此方法获得的十二指肠排出物样品中,胰蛋白酶活性范围为3067-9695(U/mL)。与传统方法获取的胰腺液样本相比,该样本中胰蛋白酶活性约为其的40-65%。这表明十二指肠排出物中胰腺液的含量与传统方法获取的样本中胰腺液的含量相当,使用此方法获取胰腺液样本可在一定程度上替代传统的胰腺液样板获取方法。
由于这种新方法具有高效、无创、受检者体验佳等优点,若结合对于排出物内相关成分的进一步研究,有望研发出创新性的胰腺液疾病诊断综合方法。
参考文献
[1] 赵成思, 等. 急性胰腺炎早期胰液细菌培养的特征及临床意义[J]. 中国普通外科杂志 32, 424–433 (2023).
[2] 陶友江, 崔萧, 张翼, 黄斌. 胰液中黏蛋白1水平对胰腺良恶性疾病的诊断价值[J]. 国际检验医学杂志 43, 2043–2046 (2022).
[3] 李洪祯, 沈珊珊. 液体活检在胰腺癌诊疗中的应用[J]. 中华胰腺病杂志 22, 420–425 (2022).
[4] 周艳, 宁波. 胰液中循环游离DNA甲基化异常在胰腺癌早期诊断中的应用[J]. 临床肝胆病杂志 36, 2145–2148 (2020).
[5] 杨志勇, 杨永成. 胰腺癌早期诊断方法初探[J]. 西北民族大学学报(自然科学版) 04, 79–81 (2005).
[6] 魏杰, 王翔. 经内镜逆行胰胆管造影术后并发胰腺炎及胆管炎的危险因素分析[J]. 中国普通外科杂志 32, 1415–1420 (2023).
[7] 侯森林, 于廷廷, 刘鹏翔,张立超. 超声内镜介入治疗在胆胰疾病中的应用[J]. 外科理论与实践 28, 300–306 (2023).
[8] 王小东, 王石. 经内镜鼻胆管引流术与经皮经肝胆管造影引流术用于肝门部胆管癌术前减黄的疗效对比[J]. 肝脏 24, 1254–1257 (2019).
[9] Cheng, S., Kupfer, K., Dixon, M. & Shammas, S. Optimized sampling design and rationale for verification and validation. Qual Reliab Eng Int 35, 483–502 (2019).
[10] Lake-bakaar, G., McKAVANAGH, S., Rubio, C. E. & Summerfield, J. A. Measurement of trypsin in duodenal juice by radioimmunoassay. Gut vol. 21 http://gut.bmj.com/ (1980).
[11] Haverback, B. J., Dyce, B., Bundy, H. & Edmondson, H. A. Trypsin, Trypsinogen and Trypsin Inhibitor in Human Pancreatic Juice Mechanism for Pancreatitis Associated with Hyper-arathyroidism.
[12] Cook, H. B., Lennard-Jones, J. E., Sherif, S. M. & Wiggins, H. S. Measurement of tryptic activity in intestinal juice as a diagnostic test of pancreatic disease. Gut 8, 408–414 (1967).
[13] Wiggins, H. S. Simple method for estimating trypsin. Gut 8, 415–416 (1967).
[14] Sacks, H., Bank, S., Kramer, I., Novis, B. & Marks, I. N. A comparison between spectrophotometric and titrimetric methods of estimating trypsin. Gut 12, 727–728 (1971).
撰写日期:2023-11
...