基于网络药理学和分子对接探讨葫芦巴防治阿尔茨海默病的作用机制
摘要
关键词
葫芦巴;阿尔兹海默病;网络药理学
正文
Methods:The main chemical components and targets of Fenugreek were screened out by TCMSP and PharmMapper databases,and AD-related targets were screened by GeneCards,OMIM,and Genemap databases.
For the targets,Venn diagram construction,PPI network construction,GO enrichment,and KEGG pathway annotation analysis were performed.
The Cytoscape row was used for the topological analysis,and the'component-target'map and the'component-target-pathway map'were constructed.
Molecular docking software was used with AutoDock for molecular docking to pair the active components and key targets,and the results were visually presented.
Results:A total of 12 active components and 47 AD-related targets were ADAM17,IGF1R,UBC and UBB.
The GO enrichment revealed 163 entries for biological processes,34 for molecular functions and 44 for cellular components,and 33 signal transduction pathways were analyzed by KEGG pathway annotation analysis.
Molecular docking results showed good receptor and ligand matching.
Conclusion:Caluba mainly regulates mitochondrial pathway,tumor pathway through ADAM17,IGF1R,UBC,UBB pathway,longevity regulation pathway,and oxidase pathway.
阿尔茨海默病(Alzheimer’s disease,AD)是老年人群痴呆症的最主要病理类型[1]。据统计,截止2021年全世界有超过5500万人罹患痴呆症,并且随着人口老龄化的不断加重,预计到2030年,这个数字将达到7800万,且将造成重大经济负担[2]。AD的发病机制复杂,主要特征为脑内细胞外β-淀粉样蛋白(Aβ)沉积和细胞内高度磷酸化的Tau蛋白积累缠结,同时也与细胞氧化应激、神经炎症反应等息息相关,最终对神经细胞造成永久性破坏,影响自身对身体的控制[3]。国内批准上市的药物多只能延缓AD进展,对AD患者的症状产生轻微益处[3-4]。相比之下,传统中药毒副作用小,能发挥多靶点、多途径的整体效应,探索开发能够有效防治AD的中药具有重大研究潜力。
AD在中医学中可归属于“痴呆”“善忘”范畴,一般认为以“肾精亏虚”“肝脾失调”作为发病机制。葫芦巴(Huluba,Trigonellae/Fenugreek)多指豆科植物葫芦巴干燥成熟种子,多用于香料制作,具有补肾祛虚的功效。现代药学将葫芦巴提取发现的药理活性成分包括多酚类、黄酮类、甾体皂苷类和多糖类等,具有抗氧化、抗炎症、降血糖、降血脂、保肝等多种药理活性[5]。
近年来,网络药理学被广泛应用于中药研究,其强调“药物-靶点-通路-疾病”的系统性调控的观念,与传统中药的统一整体观的思想相谋和[6]。葫芦巴具有多种活性成分,符合中医药“多成分、多途径、多疾病”的作用特点,因此,葫芦巴有望成为预防及治疗AD的生物活性药物,对其进行研究具有很大的临床价值。本文运用网络药理学的方法筛选出葫芦巴的有效成分、作用靶点及信号通路,进一步明确其防治AD的作用机制,为AD的治疗提供新思路。
1、材料与方法
1.1葫芦巴主要活性成分查询及靶点筛选
通过中药系统药理学数据库及分析平台(TCMSP,Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,https://old.tcmsp-e.com/tcmsp.php),以中药“胡芦巴(葫芦巴)”作为检索词得到葫芦巴的全部已收录组分。限定条件为口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug like,DL)≥0.18筛选出符合条件的候选活性成分。通过PubChem(https://pubchem.ncbi.nlm.nih.)数据库下载并保存筛选出的有效单体成分3D结构的.sdf文件。将保存的.sdf文件导入Pharmmapper(http://www.lilab-ecust.cn/pharmmapper/)数据库后,对药物有效成分单体的作用靶点进行筛选。
1.2 AD相关靶点筛选
基于OMIM数据库(https://omim.org/)、GENEMAP数据库(https://omim.org/search/advanced/geneMap)、Genecards数据库(https://www.genecards.org/)数据库以检索词“Alzheimer”进行检索,检索出与AD相关的基因位点。
1.3基因标准化
通过Uniprot(https://www.uniprot.org/)数据库将葫芦巴有效成分靶点蛋白名称转换成对应基因号(Gene ID),应用Biomart数据库(http://www.ensembl.org/biomart/martview)将相关AD靶点去重并标准化为Gene ID格式,二者均限定物种为“Homo sapiens”(人源)进行操作并去除重复。
1.4构建蛋白互作网络
运用Venny 2.1在线工具(http://bioinfogp.cnb.csic.es/tools/venny/index.html),将筛选出的AD靶基因和葫芦巴相关靶点进行交叉,并以韦恩图的形式将其可视化,交叉所得到的靶点即为葫芦巴对AD产生防治作用的靶点。于STRING 11.5数据库(https://string-db.org/)将上述获得的主要靶点在线上传,物种筛选为“智人”,同时设置靶点的最低互动分数(minimum required interaction score)为0.90,以获得蛋白质相互作用网络(protein-protein interaction,PPI)关系网络。并保存其.TSV格式文件,利用Cytoscape 3.9.1软件进行互作网络的拓扑学分析,筛选出关键靶蛋白。
1.5药物-成分-靶点网络
将以获取的葫芦巴有效成分和作用靶点导入Cytoscape 3.9.1,构建药物-成分-靶点网络,并以度值(degree)作为分析指标。
1.6生物功能和富集功能分析
将葫芦巴有效成分的靶点导入DAVID 2021数据库(https://david.ncifcrf.gov/home.jsp),分别进行生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(cellular component,CC)三个部分的基因本体(GO)富集分析,并对得到的数据进行筛选,选取三部分中聚类富集率排名前十且满足PValue<0.05的结果备用。选择KEGG Pathway对靶点进行基因通路注释分析,并将结果相关度前二十的通路备用,生物功能和富集功能分析均使用bioinformatics在线分析平台(https://www.bioinformatics.com.cn)进行作图绘制,并分别采用条形图及气泡图将结果可视化分析其功能及潜在途径。
1.7“药物成分-靶点-作用通路”网络的建立
分别构建葫芦巴“活性成分-靶点”“靶点-作用通路”Excel表,将其导入Cytoscape 3.9.1中构建“药物成分-靶点-作用通路”网络。
1.8分子对接验证
在ZINC数据库(http://zinc.docking.org/)中获取关键成分的3D结构的MOL2文件,PDB数据库(http://www.Rcsb.org/)下载核心靶点的PDB结构文件,将上述导入AutoDock软件,对活性成分和靶标蛋白进行虚拟分子对接分析。结合能用于评判分子与蛋白的相互作用强度,结合能小于0说明配体与受体可自发结合,选取结合能≤-5kJ/mol的成分作为葫芦巴治疗AD的有效成分评价标准。
2结果
2.1葫芦巴活性成分的筛选
通过在TCMSP数据库完成对葫芦巴所有已知化学成分的收集,共计59种。根据筛选标准(OB≥30%,DL≥0.18)最终得到活性成分共计12种,其中,不透过血脑屏障(Blood brain barrier,BBB)的活性成分共有6种,具有中等穿透性的活性成分共有5种,具有强穿透性的活性成分1种。详见表1。
表1葫芦巴的主要活性成分 | |||||||
序号 | Mol号 | 分子名称 | 中文名称 | 2D结构 | OB(%) | DL | BBB |
1 | MOL008519 | 新替果皂苷元 | 80.98 | 0.81 | 0.23 | ||
2 | MOL000546 | 薯蓣皂苷 | 80.88 | 0.81 | 0.27 | ||
3 | MOL000392 | formononetin | 刺芒柄花素 | 69.67 | 0.21 | 0.02 | |
4 | MOL008503 | Hiyodorilactone A | 山兰内酯A | 58.33 | 0.52 | -0.60 | |
5 | MOL000417 | Calycosin | 毛蕊异黄酮 | 47.75 | 0.24 | -0.43 | |
6 | MOL003769 | Irolone | 德鸢尾素 | 46.87 | 0.36 | -0.27 | |
7 | MOL000098 | quercetin | 槲皮素 | 46.43 | 0.28 | -0.77 | |
8 | MOL000422 | kaempferol | 山奈酚 | 41.88 | 0.24 | -0.55 | |
9 | MOL008506 | Tigogenone | 柚子酮 | 37.35 | 0.81 | 0.26 | |
10 | MOL000358 | beta-sitosterol | β-谷甾醇 | 36.91 | 0.75 | 0.99 | |
11 | MOL000006 | luteolin | 木犀草素 | 36.16 | 0.25 | -0.84 | |
12 | MOL002322 | isovitexin | 异牡荆素 | 31.29 | 0.72 | -2.01 | |
注:OB为口服生物利用度;DL为药物相似性;BBB为血脑屏障透过率。 | |||||||
2.2候选化合物靶点预测以及疾病靶点收集
将筛选后的药物有效单体成分的3D结构.sdf文件导入Pharmmapper数据库后,分别得到各个有效单体成分的Uniprot ID汇总去重校正后并转换为Gene ID,通过Biomart数据库筛选出人源相关靶点共计406个;同时通过Gene Cards数据库检索与AD相关基因后,取Relevance score≥2进行筛选,并使用OMIM数据库、Gene map数据库对相关基因进行补充,去除非人源靶点和重复靶点后,最终共得到862个AD相关基因位点。
2.3葫芦巴活性成分-靶点-通路的网络构建
将上述获取的葫芦巴活性成分和作用靶点导入Cytoscape 3.9.1软件构建“药物活性成分-靶点”网络,见图1。
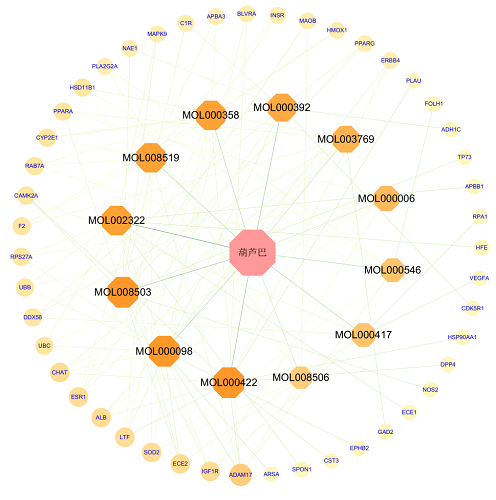
图1葫芦巴药物活性成分-靶点网络图
2.4网络构建
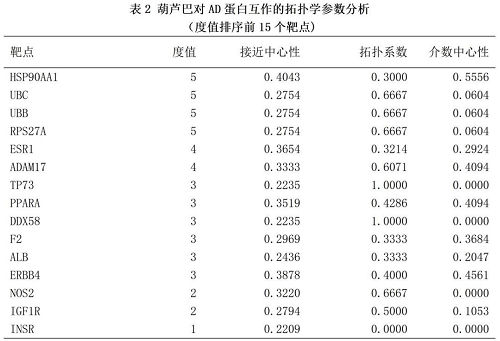
运用Venny2.1在线绘制韦恩图,得到葫芦巴有效成分相关靶点与AD相关靶点的交集靶点47个,即为葫芦巴治疗AD的潜在作用靶点,见图2。将葫芦巴与AD的交集靶点上传至STRING 11.5数据可,选择物种为“智人”,经过筛选符合置信度≥0.9的靶点共有20个,根据结果构建PPI网络图,见图3,网络图显示共有20个节点,32条边,平均节点度为1.36。将其.TSV文件导入Cytoscape3.9.1进行拓扑学参数分析,获取节点的度值、中介中心度(betweenness centrality,BC)、拓扑系数(topological coefficient,TC)、接近中心性(closeness centrality,CC)的信息,选取度值排名前15位的靶点,结果见表2。其中HSP90AA1、UBC、UBB、RPS27A均可作用5个靶点,说明这些靶点在葫芦巴蛋白作用网络中位于关键位置。
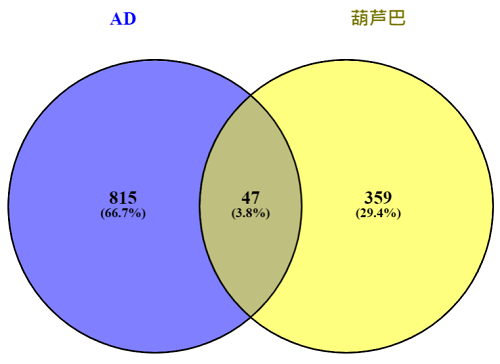
图2葫芦巴有效成分相关靶点与AD相关靶点的交集靶点
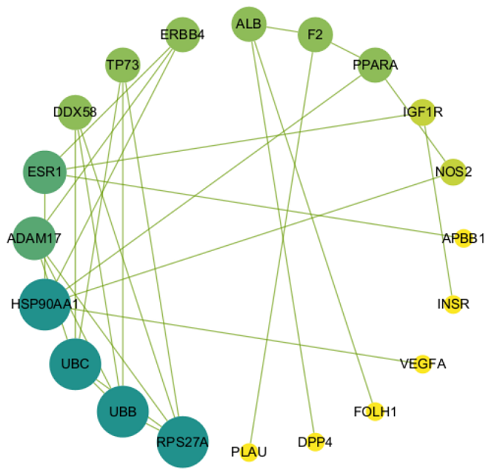
图3葫芦巴活性成分与对应靶点的复合目标网络
2.5葫芦巴有效成分治疗AD的生物功能和通路富集分析
将葫芦巴防治AD可能发挥作用的基因靶点进行GO分析及KEGG分析,并分别以柱状图和气泡图将其可视化,见图4。其中在GO分析中得到葫芦巴与AD相关的条目共342个,其中生物过程(Biological Process,BP)条目163个,分子功能(Cellular Component,CC)条目34个,细胞组分(Molecular Function,MF)条目44个。BP主要涉及了对MAPK活性失活、由共生体对宿主防御反应的调节等。CC涉及了线粒体外膜、内质网等。MF涉及了氧化还原酶活性、氧结合等。
KEGG通路注释分析共分析出33条信号转导通路,将关联度前20条通路以可视化气泡图呈现,见图5,其中包括缺氧诱导因子-1信号通路、长寿调节通路、酪氨酸激酶受体信号通路、胰岛素抵抗等。上述富集分析初步揭示了葫芦巴可能对AD产生治疗效果的信号通路,为进一步研究其抗AD作用的机制提供参考依据。
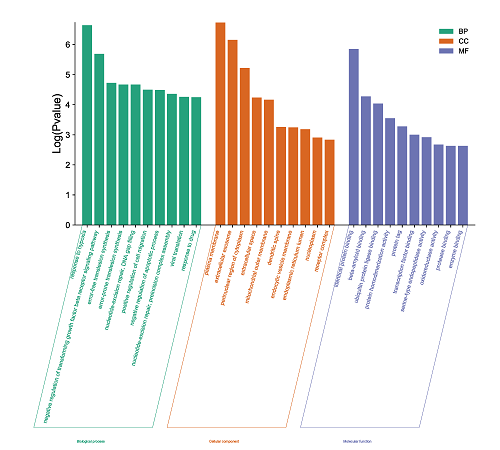
图4葫芦巴防治AD基因靶点的GO分析
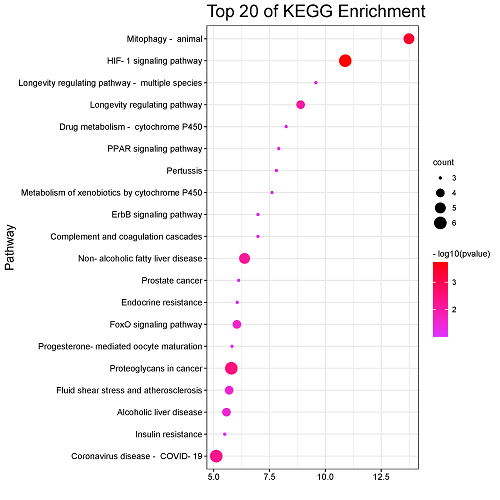
图5葫芦巴防治AD的基因靶点的KEGG分析
2.6“药物成分-靶点-作用通路”网络图构建与分析
采用Cytoscape 3.7.2软件建立“药物成分-靶点-用通路”网络图,进行拓扑学参数分析后,按度值高低调节节点在网络中的大小。结果见图6,红色节点代表葫芦巴的12个有效成分,黄色节点代表葫芦巴涉及的互作通路(P<0.05),粉色节点代表葫芦巴的直接靶点即通路涉及的靶点。并以节点大小代表其度值,度值越大节点的大小越大。
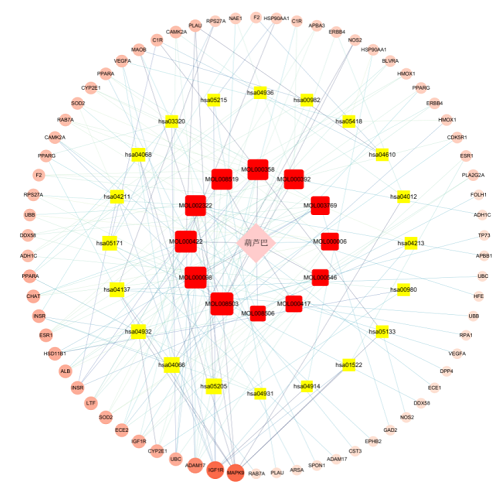
图6葫芦巴-AD“药物成分-靶点-作用通路”网络图
2.7分子对接结果
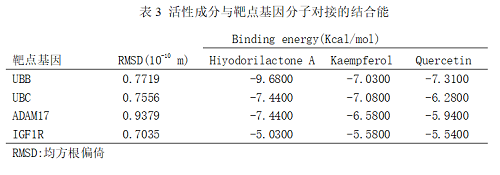
选择拓扑学参数中度值排名前3的靶HSP90AA1、UBC、UBB和“药物-成分-靶点-通路”图研究得到的关键靶点ADAM17,IGF1R,MAPK9作为受体,以葫芦巴的3个主要活性成山兰内酯A(Hiyodorilactone A)、山奈酚(Kaempferol)、槲皮素(Quercetin)作为配体,使用AutoDock Vina1.5.6软件进行分子对接。结果见图6。结果显示,UBC、UBB、ADAM17,IGF1R与葫芦巴潜在活性成分匹配性较好。
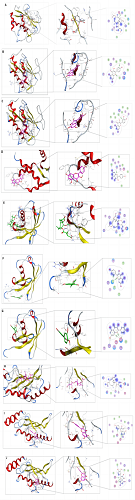
图7葫芦巴靶点基因分子对接示意图
注:A:山兰内酯A与ADAM17对接图B:山奈酚与ADAM17对接图C:槲皮素与ADAM17对接图D:山奈酚与IGF1R对接图E:山兰内酯A与UBB对接图F:山奈酚与UBB对接图G:槲皮素与UBB对接图H:山兰内酯A与UBC对接图I:山奈酚与UBC对接图J:槲皮素与UBC对接图
分子对接结果发现关键活性成分和核心靶点的结合能均≤-5.0 kJ·mol-1说明葫芦巴对AD具有治疗效果。山兰内酯A与山奈酚是筛选排名前两位的活性成分,UBB和UBC是筛选排名前两位的核心靶点,因此认为山兰内酯A与山奈酚作用于UBB和UBC是葫芦巴治疗AD的关键,对接结果显示其具有较好的结合活性,初步验证了网络药理学结果。
3讨论
AD是的病因机制复杂,与各类因素息息相关,目前主流的学说都不能完全解释AD的发病机理。葫芦巴在中医上归属肾经,有温肾壮阳、祛寒除湿,与AD在中医“肾精亏虚”的病机相契合。本研究拟通过中药葫芦巴“多成分-多通路-多靶点”的特点对AD防治机制做出探索,通过TCMSP数据库收集葫芦巴活性成分共12个,最终筛选出葫芦巴有效靶点406个,AD有效靶点862个。并通过韦恩图将结果可视化并找出交集靶点发现共有47个交集靶点可能为葫芦巴作用于AD的关键靶点,构建“药物-成分-靶点”网络图,山兰内酯A(Hiyodorilactone A)、山奈酚(Kaempferol)、槲皮素(Quercetin)可能为葫芦巴防治AD的关键组分。山兰内酯A有效地抑制脂多糖诱导的人嗜中性粒细胞炎症因子的释放,证明了山兰内酯A作为靶向炎症反应的先导物质的潜力[7]。山奈酚已被证实具有抗炎症抗氧化以及抗痴呆的潜力,山奈酚衍生物能够降低β-内分泌酶活性,从而抑制Aβ的产生,促进无毒Aβ42寡聚体形成。此外,山奈酚通过阻断小胶质细胞中的NF-κB信号通路,最终改善改善Aβ诱导的神经细胞凋亡、减少ROS产生、抑制炎症因子释放[8-9]。而槲皮素主要通过拮抗Aβ的毒性作用和抑制Tau蛋白过度磷酸化来延缓AD的发生发展,同时对神经细胞产生抗炎症、抗氧化、抗凋亡的神经保护作用,另外槲皮素还可能通过植物雌激素样作用对认知进行改善[10-12]。
研究通过蛋白-蛋白相互作用网络和“药物-成分-靶点-通路”图筛选出关键靶点后,行分子对接技术初步验证后得到匹配度良好的四个靶点:UBC、UBB、ADAM17,IGF1R。多聚泛素-C(UBC)与多聚泛素-B(UBB)均负责编码泛素蛋白。人解整合素金属蛋白酶17(ADAM17)属于经典的膜蛋白脱落酶,参与多种炎症受体的水解释放,同时也在APP非淀粉样物质代谢途径中参与α代谢途径途径,从而降低Aβ的产生。胰岛素样生长因子1受体(IGF1R),其与酪氨酸激酶结合,对于肿瘤转化和恶性细胞存活具有相关性,miR-145/IGF1R通路可能参与AD发生发展,下调海马Aβ水平延缓AD的进展[13]。
通过GO富集分析可以了解到,葫芦巴治疗AD主要通过蛋白质的分解代谢,脂肪酸的氧化代谢,MAPK通路的调节等生物学过程有关。KEGG富集通路排名靠前的条目包括线粒体通路,肿瘤通路,长寿调节通路和胰岛素代谢通路。相关结果为后续葫芦巴治疗AD的药理学研究提供一定参考。
综上所述,本研究利用网络药理学的方法对葫芦巴治疗AD的机制进行了初步性的探索,结果表明葫芦巴可通过多个靶点、多条通路发挥抗AD的作用,为其后续的药物开发及临床应用提供了参考依据。
参考文献:
[1] Gaugler,Joseph,James,et al.2021 Alzheimer's disease facts and figures[J].Alzheimer’s&dementia:the journal of the Alzheimer’s Association,2019(15-3).
[2] Gauthier S,Rosa-Neto P,Morais JA,&Webster C.2021.World Alzheimer Report 2021,Abridged version:Journey through the diagnosis of dementia.[J].London,England:Alzheimer’s Disease International.
[3] Long Justin M,Holtzman David M,Alzheimer Disease:An Update on Pathobiology and Treatment Strategies.[J].Cell,2019,179:312-339.
[4] Hardy John,Selkoe Dennis J,The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics.[J].Science,2002,297:353-6.
[5] Sevigny Jeff,Chiao Ping,Bussière Thierry et al.Addendum:The antibody aducanumab reduces Aβplaques in Alzheimer's disease.[J].Nature,2017,546:564.
[6] 毛丽斯,朱晓红.网络药理学在中药领域的应用进展[J].中医药管理杂志,2021,29(13):98-102.
[7] Michalak Barbara.,Piwowarski Jakub P.,Granica Sebastian.,Waltenberger Birgit.,Atanasov Atanas G.,Khan Shafaat Y.,Breuss Johannes M.,Uhrin Pavel.,Żyżyńska-Granica Barbara.,Stojakowska Anna.,Stuppner Hermann.,Kiss Anna K.(2019).Eupatoriopicrin Inhibits Pro-inflammatory Functions of Neutrophils via Suppression of IL-8 and TNF-alpha Production and p38 and ERK 1/2 MAP Kinases.J Nat Prod,82(2),375-385.
[8] [1]Shigao,Yang,Wen,et al.A Novel Multifunctional Compound Camellikaempferoside B Decreases AβProduction,Interferes with AβAggregation,and Prohibits Aβ-Mediated Neurotoxicity and Neuroinflammation[J].Acs Chemical Neuroscience,2016.
[9] Michelle L B,Luigi Z,Jau-Shyong H.Microgliamediated neurotoxicity:Uncovering the molecular mechanisms[J].Neuroscience,2007,8:57-69.
[10] Pattie S Green,James W Simpkins.Neuroprotective effects of estrogens:potential mechanisms of action[J].Dev Neurosci,2000,18(4-5):347-358.
[11] Michael E Mendelsohn.Protective effects of estrogen on the cardiovascular system[J].Cardiol,2002,89(12A):12E-17E.
[12] Robert Speth,Mikayla D’Ambra,Ji Hong,et al.A heartfelt message,estrogen replacement therapy:use it or lose it[J].Physiol Heart Circ Physiol,2018,315(6):H1765-H1778.
[13] Aguado-Llera D,Canelles S,Frago L M,et al.The Protective Effects of IGF-I againstβ-Amyloid-related Downregulation of Hippocampal Somatostatinergic System Involve Activation of Akt and Protein Kinase A[J].Neuroscience,2018.
...